标新生物在《Cancer Research》联合报道SOS1降解剂克服KRAS突变及BCR-ABL阳性CML耐药的机制
发布日期:2024-11-1 文章来源:标新生物
近日,标新生物与上海科技大学姜标团队、临港实验室谢成英团队合作在国际知名期刊《Cancer Research》在线发表了题为“Targeted Degradation of SOS1 Exhibits Potent Anticancer Activity and Overcomes Resistance in KRAS-Mutant Tumors and BCR-ABL-Positive Leukemia”的研究论文。该研究报道了一种新型靶向SOS1(Son of sevenless homolog 1)蛋白的PROTAC降解剂SIAIS562055,通过阻断KRAS和RAC蛋白的激酶活性,发挥显著抗肿瘤作用;与KRAS抑制剂或ABL抑制剂联用时,在KRAS突变肿瘤或BCR-ABL阳性的慢性髓性白血病(chronic myeloid leukemia,CML)中展现出显著的协同增效及抗耐药作用。

KRAS是所有已知的癌基因中突变频率最高的基因之一,其突变往往与非小细胞肺癌、胰腺癌和结直肠癌等难治性癌症的发生发展密切相关。SOS1是一种鸟苷酸交换因子(guanine nucleotide exchange factor,GEF),调控RAS和RAC等小G蛋白(small GTP binding proteins,GTPases)上鸟苷三磷酸(guanosine triphosphate,GTP)和鸟苷二磷酸酸(guanosine diphosphate,GDP)的交换,进而激活下游信号通路。理论上,抑制SOS1可以有效阻断KRAS信号,从而实现对不同类型KRAS突变的广泛抑制。此外,研究表明,BCR-ABL通过招募SOS1形成复合物,驱动下游RAS、RAC等GTPases信号的激活,参与BCR-ABL驱动CML等血液肿瘤的发生发展,因此,SOS1可能是治疗CML的潜在靶点。目前尚未有SOS1抑制剂获得上市批准,多款SOS1抑制剂正在进行临床研究,旨在治疗KRAS突变肿瘤。然而,小分子SOS1抑制剂在临床研究中面临药代动力学、安全性以及单用有效性等问题,而将其作为治疗CML的潜在策略尚未得到充分探索。因此,亟需开发新的策略,以有效抑制或降解SOS1,并拓展靶向SOS1疗法的适应症。
研究团队基于SOS1小分子抑制剂BI-3406类似物、CRBN配体及多种类型连接体,合成一系列SOS1 PROTAC分子。经过分子、细胞和药代动力学研究等,筛选出对SOS1具有高降解活性的PROTAC分子SIAIS562055,该化合物能够持续降低SOS1水平并抑制下游信号,与小分子抑制剂相比,在KRAS突变型肿瘤和BCR-ABL阳性CML中均显示出更优的抗肿瘤活性。进一步的研究表明,在KRAS突变肿瘤及KRAS抑制剂获得性耐药模型中,SIAIS562055与KRAS抑制剂联合使用时表现出显著的协同抗肿瘤活性,进一步抑制ERK信号通路,诱导肿瘤退缩,并克服耐药。在BCR-ABL阳性 CML中,SIAIS562055通过上调有机阳离子载体蛋白SLC22A4,促进BCR-ABL抑制剂的主动摄取,与BCR-ABL抑制剂联用,协同增强对ABL磷酸化及下游信号的抑制,在小鼠异种移植模型和原发性CML患者样本中均表现出强大的抗肿瘤活性,且未表现明显的毒性。
综上,新型SOS1 PROTAC SIAIS562055能有效降低SOS1下游信号通路的活性,显著抑制KRAS突变及BCR-ABL阳性肿瘤体内外生长,与KRAS抑制剂或BCR-ABL抑制剂发挥协同抗肿瘤作用并克服耐药(图1)。此外,本研究拓展了SOS1靶点的适用范围,为克服KRAS及BCR-ABL抑制剂耐药问题提供了重要的实验依据。
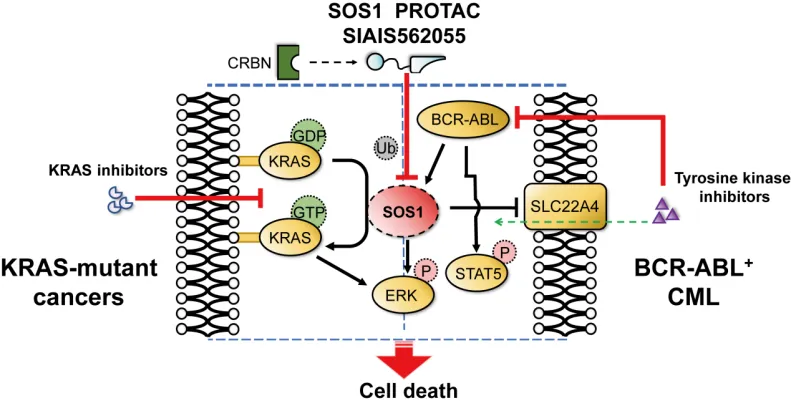
图1 SIAIS562055持续降解SOS1,抑制下游信号通路,在KRAS突变肿瘤中与KRAS抑制剂联用,以及在CML中与BCR-ABL抑制剂联用,均显示出协同增效和克服耐药作用
上海科技大学免疫化学研究所/生命科学与技术学院博士生罗自为和硕士生林宸岑为本文共同第一作者。临港实验室谢成英研究员、上海科技大学免疫化学研究所特聘教授姜标院士、标新生物杨小宝博士为本文共同通讯作者。本项目获得临港实验室(LG202101-01-06)和国家重点研发计划项目(2022YFC3401500)的资助,同时本项目还得到上海科技大学免疫化学研究所仪器平台、中国科学院上海药物研究所、上海交通大学附属第一人民医院、上海中医药大学附属曙光医院大力支持。
论文链接: