标新生物联合复旦大学孙涛/蒋晨团队开发靶向BRD4降解的PROTAC纳米胶囊,突破胶质母细胞瘤放化疗耐药瓶颈
原创 专注蛋白降解的 标新生物GLUETACS2025年03月15日 15:00上海
发布日期:2025-3-15 文章来源:标新生物
胶质母细胞瘤(GBM)是恶性程度最高的原发性脑肿瘤,患者生存期短且易复发。传统放化疗因血脑屏障阻隔、DNA损伤修复激活及肿瘤耐药性等问题疗效有限。BRD4蛋白作为调控肿瘤生长和DNA修复的关键靶点,因其缺乏有效小分子抑制剂,成为治疗难点。PROTAC技术能高效降解BRD4,需进一步解决体内靶向性差、易引发全身毒性等潜在问题。
标新生物联合复旦大学孙涛/蒋晨团队创新性设计了一种GSH响应型纳米胶囊,成功实现PROTAC分子(SIS)的精准递送。该纳米胶囊通过表面修饰的1-甲基-L-色氨酸(MLT)靶向脑肿瘤高表达的LAT1转运体,穿透血脑屏障并富集于肿瘤组织;在肿瘤微环境高浓度谷胱甘肽(GSH)触发下快速释放SIS,通过泛素-蛋白酶体系统降解BRD4蛋白,阻断DNA损伤修复通路。同时,纳米胶囊消耗GSH打破氧化还原平衡,提升放疗诱导的活性氧(ROS)水平,进一步放大DNA损伤效应。
该纳米胶囊具有GBM靶向性和GSH响应性药物释放特性,能够在肿瘤微环境中精准释放药物,抑制DNA损伤修复,从而增强放疗和化疗的效果。这一策略不仅提高了治疗效果,还减少了系统性毒性,为未来的脑肿瘤治疗提供了新的方向。相关成果以“PROTAC-loaded nanocapsules degrading BRD4 for radio-chemotherapy sensitization in glioblastoma” 为题,在线发表于国际知名期刊《Acta Pharmaceutica Sinica B》。

研究亮点:
(1)双重增敏机制:降解BRD4抑制DNA修复 + 提升ROS增强放疗杀伤,显著增强TMZ化疗与放疗的协同效应。
(2)精准靶向递送:体内实验显示,MLT修饰使纳米胶囊在脑肿瘤组织的蓄积量较非靶向组提高3倍,且显著减少肝部蓄积。
(3)高效低毒验证:联合治疗使荷瘤小鼠生存期延长至24天(对照组仅16天),且主要器官未见毒性损伤,血液生化指标正常。
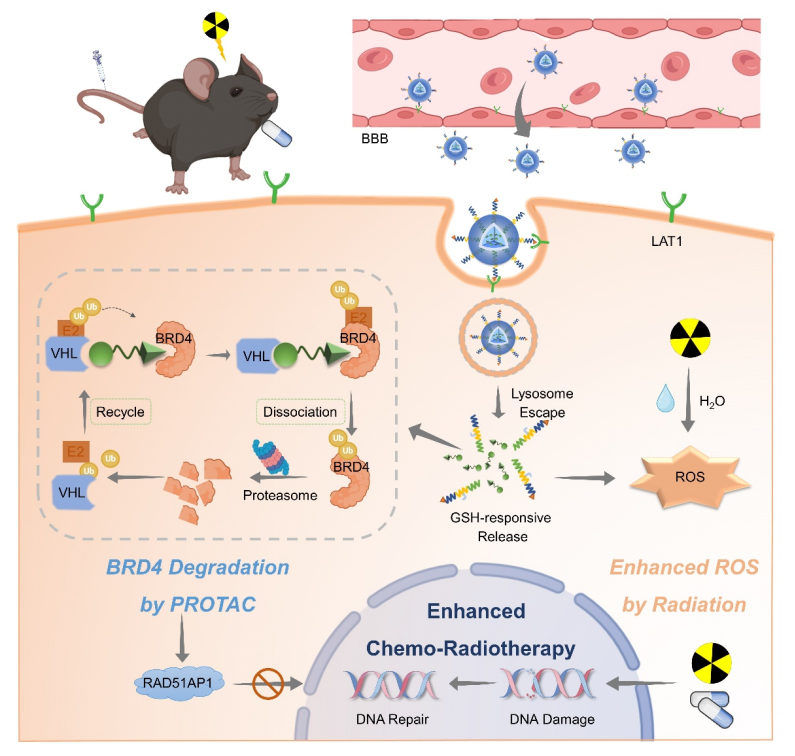
图:MPL~(SS)~P@SIS纳米胶囊的作用机制示意图及体内抗肿瘤原理
该研究为PROTAC技术的临床转化提供了新型纳米递送策略,首次实现BRD4的肿瘤特异性降解与放化疗增敏的协同调控,为恶性脑瘤治疗开辟了新方向。复旦大学研究生郭赟为该论文的第一作者,复旦大学孙涛副教授、蒋晨教授为该论文的共同通讯作者,标新生物为本文共同合作单位。该研究得到了国家自然科学基金委,国家重点研发计划,上海市科技重大专项和张江实验室的支持。
论文链接:https://www.sciencedirect.com/science/article/pii/S2211383525001546?ref=pdf_download&fr=RR-7&rr=9201f503aed38591