标新生物在《生物化学杂志》联合发表论文,开发降解酪氨酸激酶FER的PROTAC用于抑制卵巢癌细胞运动和侵袭
发布日期:2023-05-17 文章来源:标新生物
今日,标新生物、上海科技大学和南京市妇幼保健院在国际学术期刊《J. Biol. Chem.》上联合在线发表论文“Development of the non-receptor tyrosine kinase FER-targeting PROTACs as a potential strategy for antagonizing ovarian cancer cell motility and invasiveness”,报道了新型靶向酪氨酸激酶FER的PROTAC降解剂,并对其进行抑制卵巢癌细胞运动性和侵袭性的机制探究。
卵巢癌致死率在妇科癌症中排名第一,在所有癌症中排名第五。目前学术界对卵巢癌发生发展和扩散转移的分子机制不很清楚,这成为严重制约卵巢癌治愈率的关键因素。由酪氨酸激酶和磷酸酶精确调控的酪氨酸磷酸化以时空依赖的方式调节多层信号网络,这种翻译后修饰的异常与疾病密切相关。
经过前期积累,团队发现非受体酪氨酸激酶FER在卵巢癌发生发展、扩散转移和不良预后中起到重要作用,但是靶向该激酶的高效型小分子抑制剂还未被报导。同时研究发现FER能通过不依赖激酶活性的分子机制影响肿瘤细胞的迁移能力,因此仅仅靶向激酶活性还远远不够。蛋白降解靶向嵌合体(PROTACs)技术通过同时靶向靶标的酶活和支架功能,相比传统的小分子抑制剂具有更明显的优势。
基于此,参考目前已经报道过的具有良好降解效力的PROTAC设计策略,结合当前已有的激酶靶向小分子的药物结构,本研究合理选择、设计了两部分配体结构,获得了一系列FER蛋白靶向的PROTAC化合物。本研究对合成的一系列潜在靶向FER的小分子降解剂进行了体外活性初筛,分析其在卵巢癌细胞中对FER蛋白的降解能力。最终得到了两个潜在的候选FER PROTAC化合物,并进行了深入的生物活性评价与机制探究,包括降解普适性、DC50测定、降解外源性FER的能力测定、降解速率、降解途径和降解靶点专一性等。
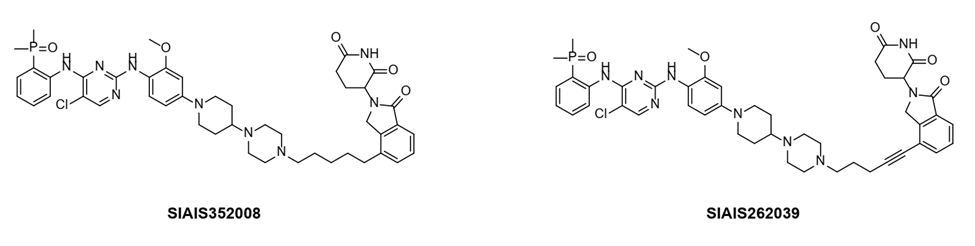
图1:候选FER PROTAC化合物的结构式
随后本研究通过增殖、细胞周期、凋亡、划痕以及迁移等体内外实验验证候选化合物在卵巢癌细胞运动性和侵袭性中的抑制作用。以上PROTAC降解FER蛋白系统的建立,将更好地评估和验证酪氨酸激酶FER作为卵巢癌新靶点的有效性,为针对其进一步的药物开发提供关键性的理论支持。同时也为应用PROTAC策略抑制卵巢癌等具有FER激酶异常表达的癌症转移奠定了实验基础。
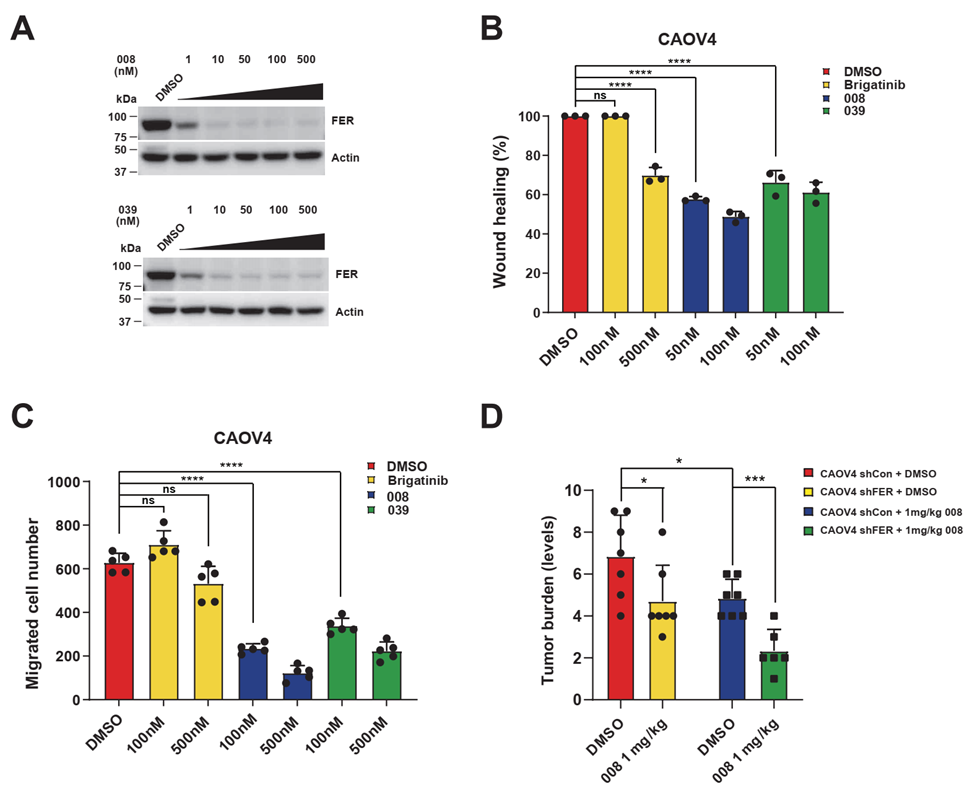
图2:候选FER PROTAC化合物对FER蛋白的降解能力以及在体内外对卵巢癌细胞运动和侵袭性的抑制作用
新型融合基因的鉴定对改善疾病的分类、生物学理解和靶向治疗有重要意义。本研究最后部分成功验证了候选化合物具有降解多种致癌FER融合蛋白的能力,体现了其对表达FER融合蛋白的患者的治疗潜力。此策略对很多融合蛋白具有普适性,它的开发、构建和完善可以有效地扩大PROTAC技术的适应症范围。
本篇论文的发表标志着一个企业、高校和医院三方合作进行源头创新的新模式的诞生,从医院层面充分挖掘未满足的临床需求,基于高校的前沿科研成果,以企业为主体逐步实现转移转化,为中国创新药研发持续注入源头活水,实现科研价值、商业价值和临床价值的三方共赢。
PRESS RELEASE
Shanghai, China – 17 May 2023
Gluetacs Therapeutics jointly published an article in Journal of Biological Chemistry, reporting a new PROTAC inhibitor targeting tyrosine kinase FER, and exploring its mechanism of inhibiting ovarian cancer cell motility and invasiveness.
Article Link:https://www.jbc.org/article/S0021-9258(23)01853-7/fulltext